Zarnu mikrobiota: nozīmīga imūnsistēmas darbības nodrošināšanā
Zarnu mikrobiotu veido vairāk nekā 35 000 baktēriju sugu, kā arī miljoni citu mikroorganismu, piemēram, vīrusi, sēnītes, arheji un vienšūņi [1]. Daudzveidīgā kopiena lielākoties simbiozē ar cilvēka organismu un var ietekmēt tā darbību [1].
Veselīga un sabalansēta zarnu mikrobiota palīdz imūnsistēmai cīnīties ar patogēniem, tolerējot nekaitīgas vielas [2,3], kas citādi varētu izraisīt alerģijas, piemēram, ziedputekšņus un piena olbaltumvielas (kā rezultātā smagas alerģiskas reakcijas rodas reti vai nemaz). Un otrādi — nesabalansētai zarnu mikrobiotai, ko dēvē arī par zarnu mikrobiotas „disbioze”, ir saistība ar alerģijām un tādām slimībām kā astma, iekaisīgi zarnu darbības traucējumi, ekzēma un diabēts [4,5].
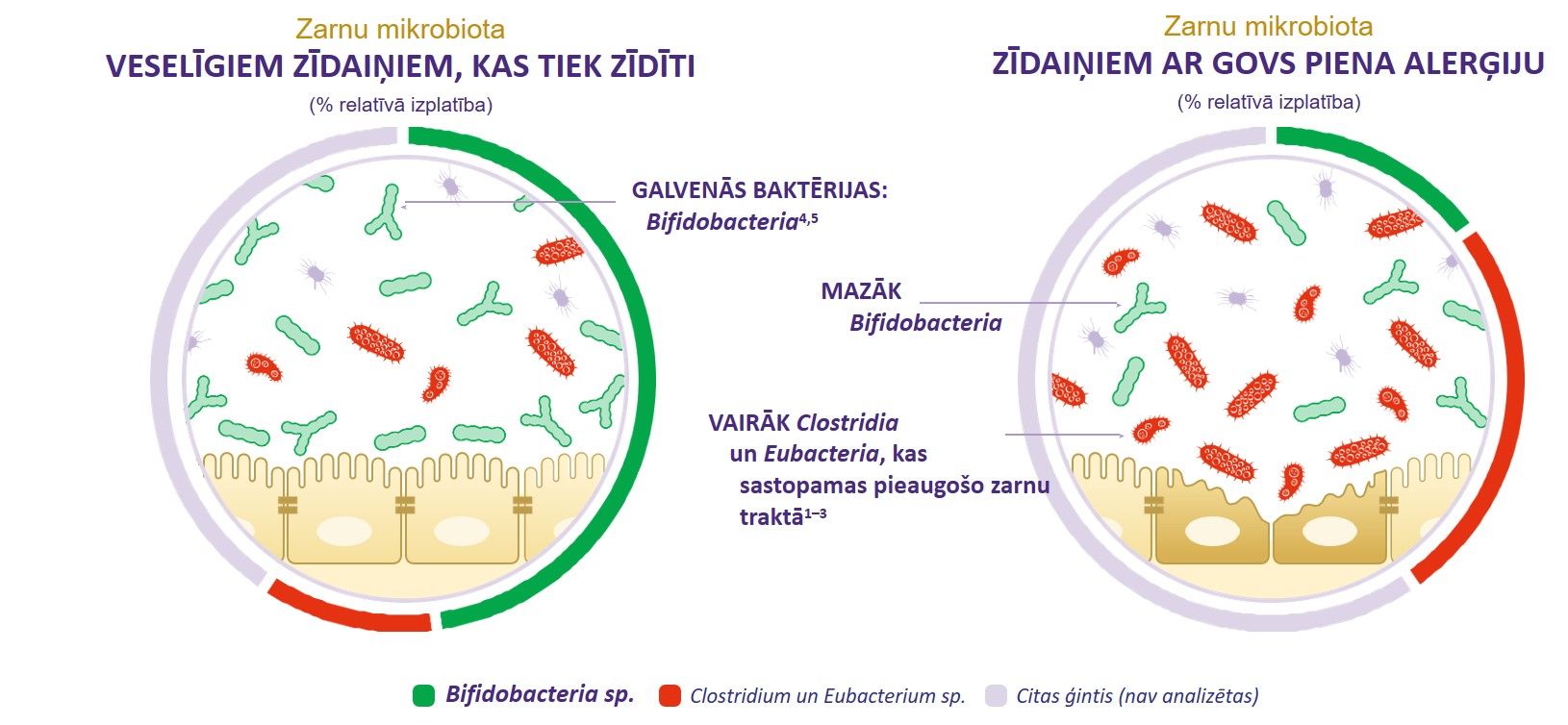
Mūsdienās tiek iegūts arvien vairāk pierādījumu, kas apliecina, ka zarnu mikrobiotas disbioze agrīnā dzīves posmā ir cieša saistība ar pārtikas izraisītu alerģiju attīstību, to vidū arī govs piena alerģiju (GPA) [6,7]. Zīdaiņiem ar GPA salīdzinājumā ar veselīgiem mazuļiem ir nesabalansēta zarnu mikrobiota un zemāks bifidobaktēriju līmenis zarnu traktā[7].
1. Canani RB et al. ISME J. 2016;10(3):742–750. 2. Thompson-Chagoyan OC et al. Pediatr Allergy Immunol. 2010;21(2p2):e394–e400. 3. Candy DCA et al. Pediatr Res. 2018;83(3):677–686. 4. Harmsen HJ et al. J Pediatr Gastroenterol Nutr. 2000;30(1):61–67. 5. Scholtens PAMJ et al. J. Annu Rev Food Sci Technol. 2012;3(1):425–447
Lai gan joprojām nav skaidrs, kā tieši zarnu mikrobiotas disbioze spēj izraisīt pārtikas alerģiju, pētījumi ir apliecinājuši, ka zarnu mikrobiota ietekmē imūnsistēmu, mainot organisma vielmaiņu un imūnreakciju [1,4]. Tieši tāpēc zīdaiņiem ar GPA, kuri ir vairāk pakļauti infekcijām [8], var būt nepieciešams ne tikai efektīvs līdzeklis alerģisko simptomu novēršanai, bet arī disbioze zarnu mikrobiotas balansa atjaunošanai, kurai, iespējams, ir saistība ar novājinātu imūnsistēmu.
Agrīnais dzīves posms: galvenais zarnu mikrobiotas attīstības periods
Pirmās 1 000 dzīves dienas ir īpaši svarīgas veselīgas zarnu mikrobiotas attīstībai[9]. Bērna zarnu mikrobiota ar laiku mainās un pilnībā nobriest aptuveni trīs gadu vecumā[10-12].
Ja šajā jutīgajā periodā tiek traucēts zarnu mikrobiotas trauslais līdzsvars, slimību rašanās risks var palielināties ne tikai zīdaiņa vecumā, bet arī vēlākajos gados[9]. Faktori, kas agrīnā dzīves posmā var ietekmēt zarnu mikrobiotu{1]:
- Piedzimšanas veids. Vagināli dzimuši mazuļi piedzimšanas brīdī nonāk saskarē ar atšķirīgu mikrobiotu nekā tie, kas dzimuši ar ķeizargrieziena palīdzību. Tas ietekmē baktēriju sastāvu zarnu traktā[13].
- Antibiotiku lietošana. Daži pētījumi liecina, ka antibiotiku lietošana agrīnā dzīves posmā maina un samazina zarnu mikrobiotas daudzveidību[14].
- Vides faktori. Tiek uzskatīts, ka ķīmisko vielu un piesārņotāju iedarbība, kas nonāk organismā tos norijot un/vai ieelpojot, ietekmē zarnu mikrobiotas sastāvu[15-17].
- Uzturs agrīnā dzīves posmā. Uzturam pirmajos dzīves mēnešos ir svarīga nozīme zarnu mikrobiotas izveidē, jo tas var ietekmēt alerģiju attīstību[18].
Uzturs agrīnā dzīves posmā un veselīga zarnu mikrobiota
Mātes piens ir labākais uzturs zīdaiņiem, jo tas satur ne tikai visas normālai augšanai un attīstībai nepieciešamās uzturvielas, bet arī spēj veidot veselīgu zarnu mikrobiotu. Ar mātes pienu mazulis uzņem labvēlīgās baktērijas (piemēram, Bifidobacterium), kā arī ogļhidrātus, ko sauc par oligosaharīdiem, kas veicina labvēlīgo baktēriju augšanu zīdaiņu zarnu traktā[19-21]. Parasti zīdaiņu, kas uzturā saņem mātes pienu, zarnu trakta mikrobiotā dominē bifidobaktērijas, salīdzinot ar zīdaiņiem, kas saņem piena maisījumu[9].
Ja mazuli nav iespējams barot tikai ar mātes pienu, tad tāda piena maisījuma ieviešana uzturā, kas paredzēts zarnu mikrobiotas atbalstam, var palīdzēt attīstīt sabalansētu zarnu mikrobiotu un tādējādi sekmēt mazuļa veselību gan īstermiņā, gan arī ilgtermiņā[19-22].
1. Jandhyala SM et al. World J Gastroenterol. 2015: 21(29); 8787–803.
2. Azad M, et al. Clin Exp Allergy 2015;45:632–43.
3. Kirjavainen P, et al. Gut 2002;51:51–5.
4. Valdes AM et al. BMJ 2018; 361: k2179.
5. Frati F et al. Int. J. Mol. Sci. 2019: 20; 123–34.
6. Lee et al. Clin Mol Allergy 2020: 18; 5–15.
7. Dong P et al. Saudi J Biol Sci. 2018: 25; 875–80.
8. Woicka-Kolejwa et al. 2016 (independent study)
9. Robertson RC et al. Trends Microbiol. 2019; 27(2): 131–47.
10. Wopereis H, et al. Pediatr Allergy Immunol, 2014;25:428-38
11. Scholtens PA, et al. Annu Rev Food Sci Technol, 2012;2:425-47
12. Arrieta MC, et al. Front Immunol, 2014;5:427
13. Neu J, et al. Clin Perinatol, 2011 ;38(2) :321-31
14. Ahmadizar F, et al. Pediatr Allergy Immunol, 2017;28(5):430-7
15. Patel MM, et al. Environ Res, 2011;111(8):1222-29
16. Ryan PH, et al. J Allergy Clin Immunol, 2005;116(2):279-84
17. Ryan PH, et al. Am J Respir Crit Care Med, 2009;180(11):1068-75
18. Berni Canani R, et al. Front Immunol, 2019 ;10 :191
19. Walker WA, et al. Pediatr Res. 2015; 77(1–2): 220–8.
20. Bergmann H, et al. British J Nutr. 2014; 112: 1119–28.
21. Hunt KM, et al. PLoS One 2011; 6(6): e21313.
22. Chua M, et al. JPGN 2017; 65: 102–6.